在过去的十年中,针对急性髓性白血病(AML)的免疫疗法取得了相当大的进展,但绝大大多数患者仍然面临着复发的危险。免疫疗法是一种极具前景的抗癌策略,它利用宿主免疫系统来识别和杀死癌细胞。然而,AML和其它肿瘤细胞可以激活多种免疫逃避机制,如下调主要组织相容性复合体I类(MHC-I)分子,或上调程序性细胞死亡蛋白配体1 (PD-L1),躲避机体内免疫细胞的攻击。这种免疫逃避机制包括遗传和表观遗传介导的基因的改变。与基因突变不同,表观遗传改变是可逆的,因此,表观基因组可以被重新编程来逆转基因的表达,表观遗传疗法也是治疗包括AML在内的多种癌症的一种新策略。
近日,四虎影视
无机合成与制备化学国家重点实验室闫飞课题组提出一种纳米表观治疗新策略,并以“A Bimetallic Metal–Organic Framework-Based Biomimetic Nanoplatform Enhances Anti-Leukemia Immunity via Synchronizing DNA Demethylation and RNA Hypermethylation”为题发表在Advanced Materials上。四虎影视
无机化学专业2020级在读硕士研究生宋岳为该论文的第一作者。

课题组构建了一种基于金属有机骨架(MOF)的双金属仿生纳米平台(AFMMB),该平台由DNA去甲基化酶抑制剂、白血病干细胞(LSCs)膜和促自噬肽(Beclin-1)组成。由于LSC膜的归巢效应和免疫相容性,AFMMB纳米颗粒可同时靶向白血病细胞(LBs)和白血病干细胞,并通过与高尔基体中的GAPR-1蛋白结合来诱导自噬。自噬引发AFMMB降解释放出小分子抑制剂(AZA)、Mn2+和Fe3+,其中,AZA和Mn2+通过抑制DNA甲基化来恢复STING通路,从而增加MHC-I分子的表达。而Fe3+的积累使内源性铁依赖的m6A去甲基化酶失活,从而增加整体m6A RNA修饰并抑制PD-L1转录稳定性。这种双重表观遗传作用通过上调MHC-I分子和下调PD-L1,增强了AML细胞的免疫原性,从而增强了毒性T细胞对肿瘤细胞的识别和杀伤能力(图1)。
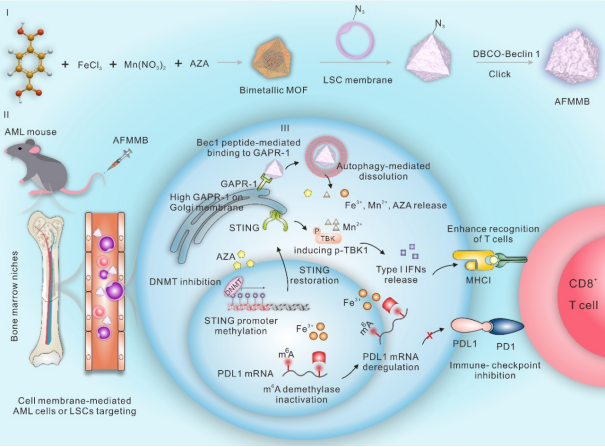
图1基于双金属MOF仿生纳米系统协同DNA去甲基化和RNA甲基化增强白血病免疫治疗机制示意图
课题组以铁基MIL-53为骨架,采用溶剂热法合成了由铁和锰离子组成的双金属MOF,然后将难溶的DNA去甲基化药物AZA载到MOF的孔隙中。之后,用叠氮标记的小鼠LSCs膜(CD34+CD38-)包裹,并通过“点击化学”与Beclin-1肽结合形成AFMMB。通过透射电镜(TEM)、粉末X射线衍射(XRD)、X射线光电子能谱(XPS)等方法对AFMMB的形貌及结构进行了表征(图2)。
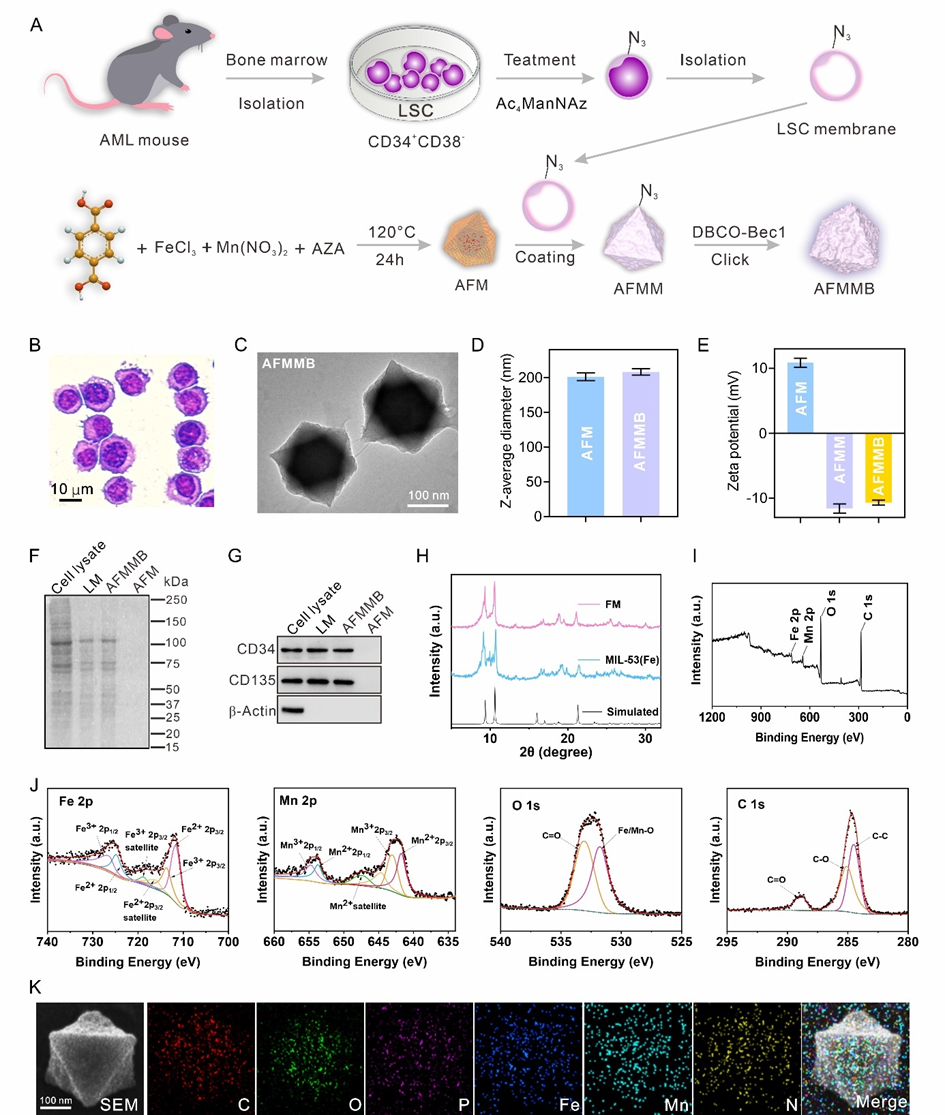
图2 AFMMB的制备与表征
通过荧光共聚焦成像、ICP-MS、Western blot等方法,证明AFMMB能通过Beclin-1结合高尔基体,并诱导细胞自噬。利用ICP-MS和IVIS成像发现在对白血病小鼠尾静脉注射AFMMB的12h后,小鼠骨髓中的AFMMB含量达到峰值,而心、脾、肺和肾脏中的AFMMB含量相对较低(图3)。体内体外数据结果表明AFMMB对AML具有良好的靶向性。
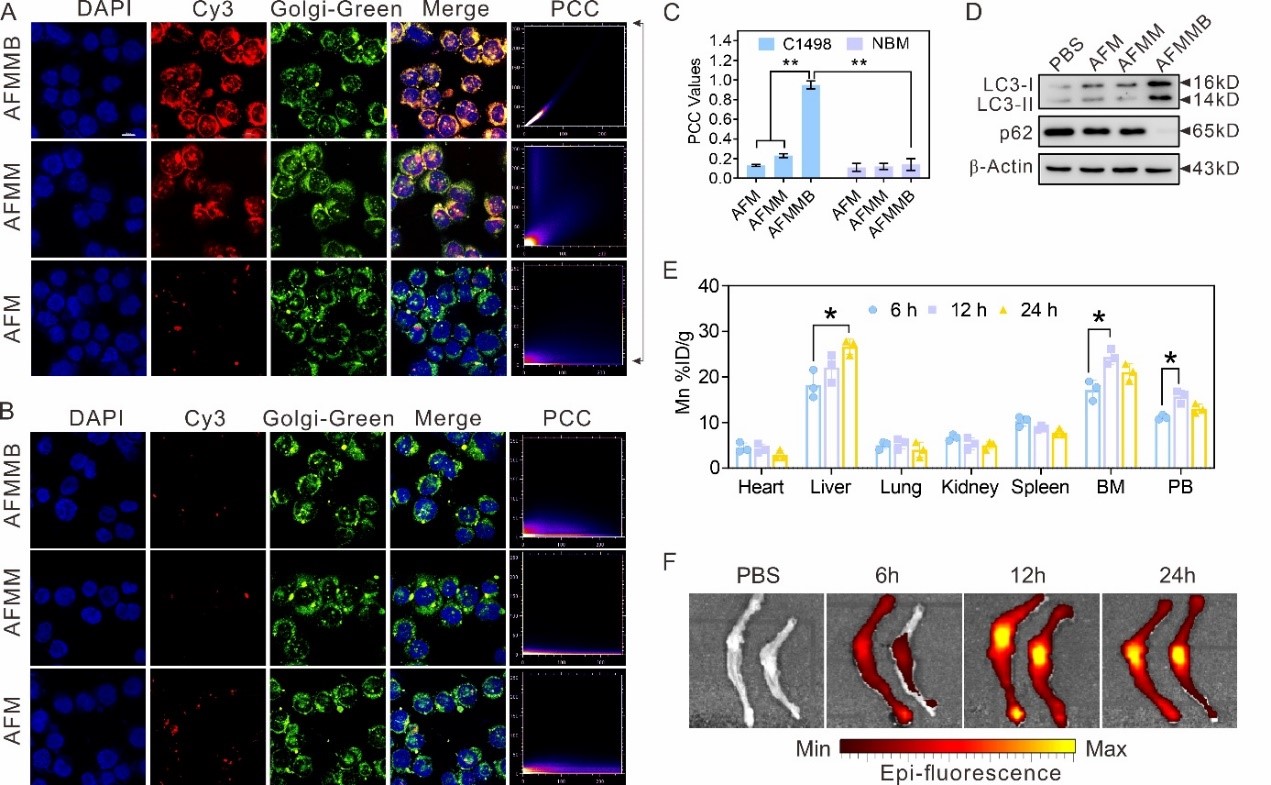
图3 AFMMB通过选择性靶向高尔基体而富集白血病细胞中
利用分子生物学方法证明了AFMMB可以通过调节DNA和RNA甲基化来表观调控免疫治疗相关基因STING,MCHI和PD-L1。AFMMB能抑制DNA甲基化转移酶DNMT1的表达并重新激活了STING信号通路,Mn2+进一步增强下游TKB-1的磷酸化水平,导致IFN-I的释放量大幅增加进而诱导MCHI表达。此外,AFMMB能通过Fe离子增加了m6A-RNA的甲基化修饰进而影响靶基因PDL1转录稳定性。这种双表观遗传调控不仅能诱导C1498细胞程序性铁死亡还能以剂量依赖的方式诱导凋亡(图4)。
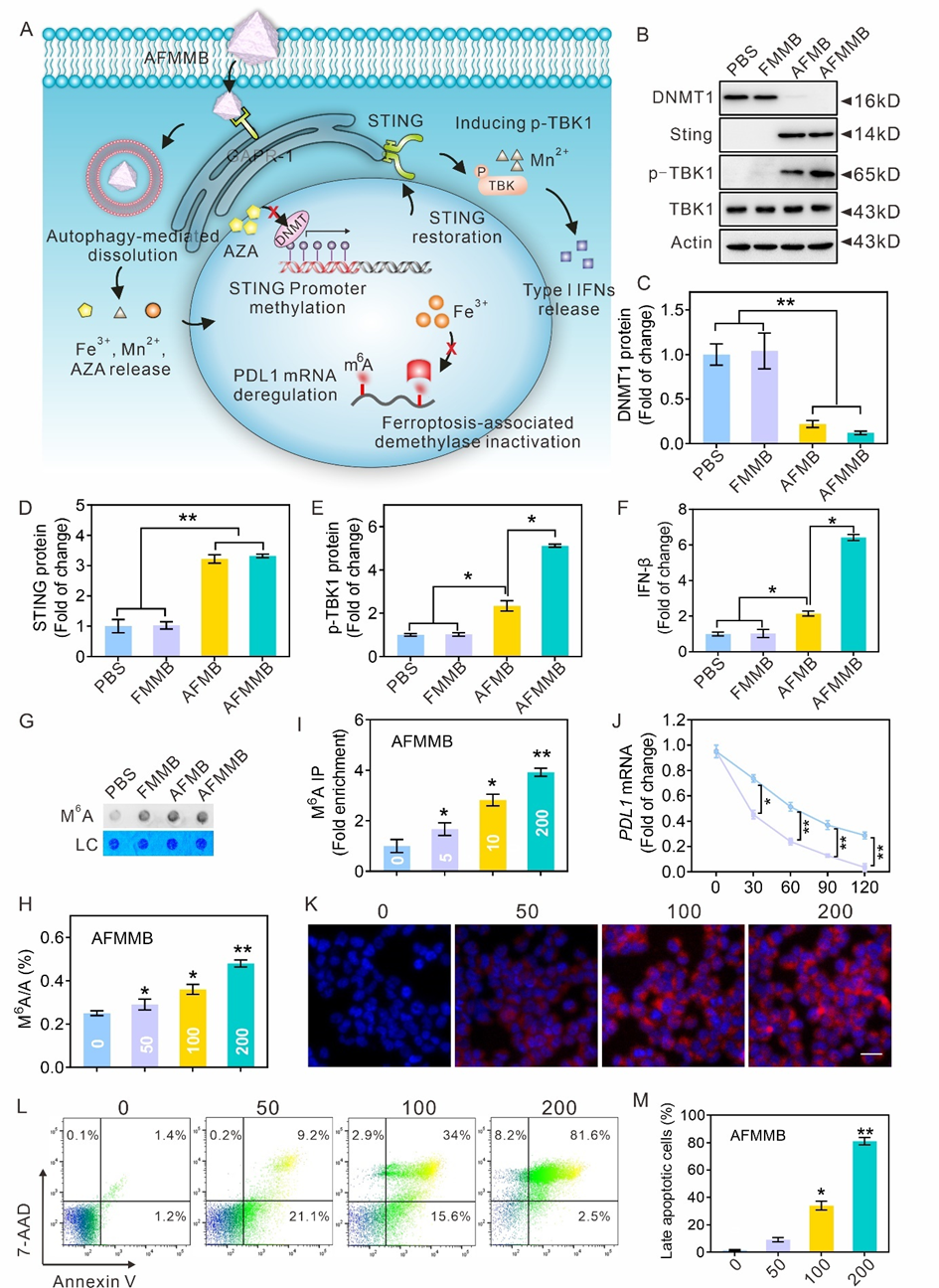
图4. AFMMB通过调控DNA和RNA甲基化介导的STING和PD-L1表达
通过建立小鼠白血病模型,进一步检测AFMMB对AML的治疗作用(图5)。AFMMB显著减少白血病小鼠脾脏转移性白血病细胞数,逆转了脾肿大,延长了小鼠得生存期。此外,AFMMB治疗显著上调了白血病干细胞中的MHC-I并降低了PD-L1的表达。同时,AFMMB治疗组小鼠的CD8+T细胞比例显著高于其他组,表明机体内免疫系统的激活。
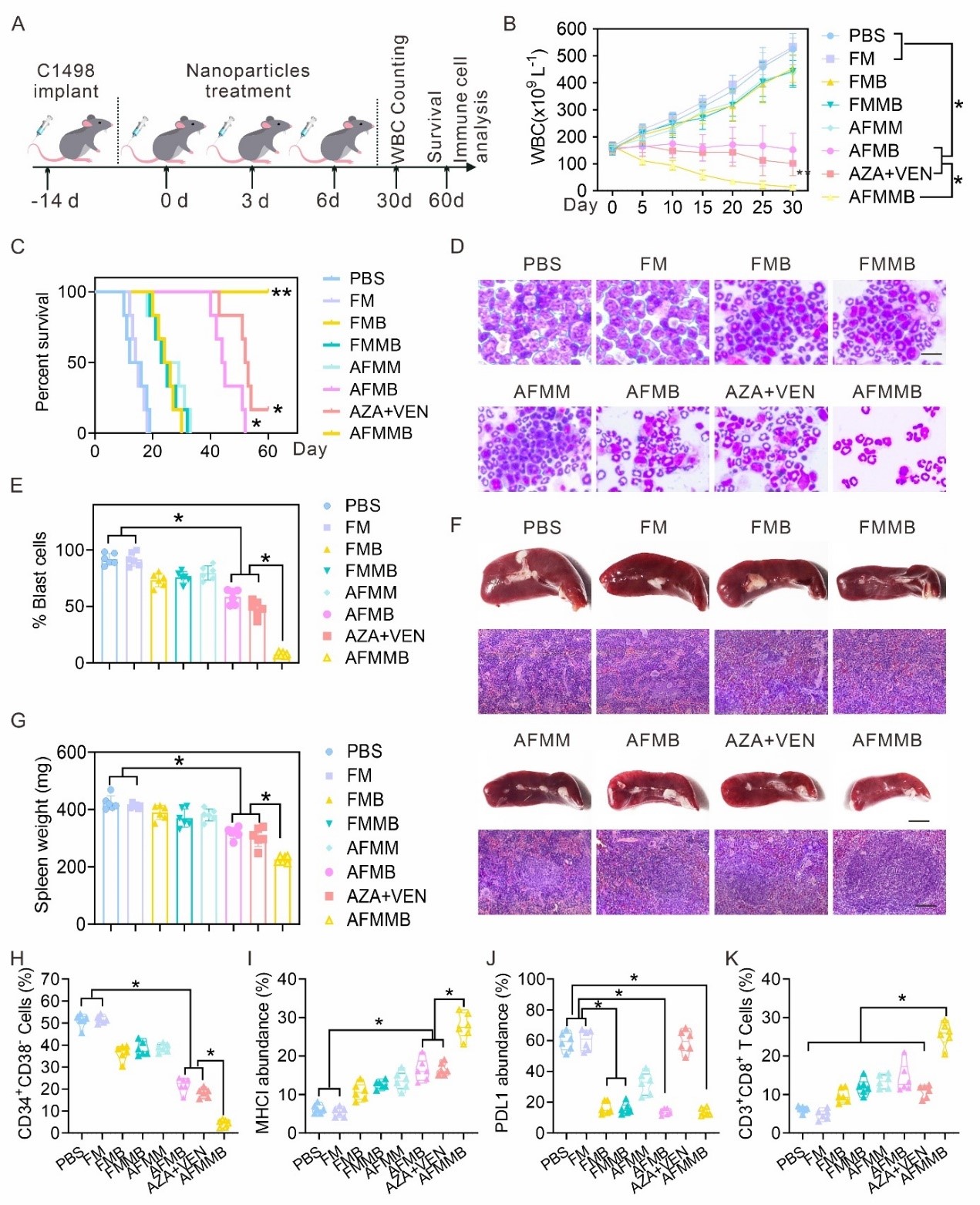
图5. AFMMB对白血病小鼠的免疫治疗效果
总结:课题组开发了一种基于MOF的双金属“纳米药物”,用于同时诱导AML细胞的DNA去甲基化和RNA高甲基化进而增强免疫治疗效果。这种治疗策略不仅能对白血病有显著的疗效,还能抑制实体肿瘤的生长和转移。该新型纳米平台在恶性血液病和实体瘤的治疗中具有较为广阔的应用前景,并有待于进一步的临床验证。
原文链接: